Molekulární klasifikace endometriálních karcinomů
Nejdůležitější fakta o molekulární klasifikaci
Molekulární klasifikace endometriálních karcinomů
Počátek molekulární klasifikace nádorů endometria je spjat s publikací The Cancer Genome Atlas (1). Tato molekulární klasifikace dělí nádory endometria na 4 skupiny nádorů, které na rozdíl od předchozích klasifikací neberou v potaz morfologii ani grade nádorů, a mají nejen rozdílné molekulární charakteristiky, ale i jiné prognózy, a hlavně odlišné terapie.
Největším benefitem je definice první skupiny POLE mutovaných nádorů, představující asi 10-12 % endometriálních nádorů, které mají vynikající prognózu a nevyžadují většinou žádnou terapii, což představuje nejen zásadní zdravotní benefit pro naše ženy s tímto nádorem, ale i velkou finanční úsporu, která zlevní celý management žen s těmito nádory. A to, doufáme, nalezne pozitivní odezvu u našich zdravotních pojišťoven.
Recentní mezinárodní doporučené postupy, včetně společného doporučení Evropské společnosti gynekologické onkologie, Evropské společnosti pro radioterapii a onkologii a Evropské společnosti pro patologii proto zahrnují molekulární klasifikaci do standardních diagnostických algoritmů (2). Stejně tak je molekulární testování doporučováno i v nejnovější, 5. edici, klasifikace nádorů ženského genitálu podle Světové zdravotnické organizace z roku 2020.
Vzhledem k potřebě implementace těchto doporučení do diagnostické praxe v ČR proběhlo jednání zástupců čtyř odborných společností České lékařské společnosti J. E. Purkyně (České onkologické společnosti, Onkogynekologické sekce České gynekologické a porodnické společnosti, Společnosti radiační onkologie, biologie a fyziky a Společnosti českých patologů). Výsledkem tohoto jednání je doporučení pro molekulární testování karcinomu endometria v rutinní diagnostické praxi v ČR (3).
Pro laickou veřejnost též přinášíme krátké video o významu této klasifikace: https://youtu.be/sIgPJUMpY7M
Reference
- Levine DA, Kandoth C, Schulz N et al. Integrated genomic characterization of endometrial carcinoma. Nature 2013:497:67-74.
- Concin N et al. ESGO/ESTRO/ESP guidelines for the management of patients with endometrial carcinoma. Virchows Archive 2021:478:153-190.
- Dundr P, Cibula D, Doležel M, Fabián P, Fínek J, Jirásek T, R Matěj R, Petruželka L, Rob L, Ryška A, Švajdler M, Weinberger V, Zikán M. Molekulární testování u karcinomu endometria – společné doporučení ČOS, onkogynekologické sekce ČGPS, SROBF a SČP ČLS JEP. Ceska Gynekol 2021:86:264–272.
Skupiny endometriálních karcinomů
definované novou molekulární klasifikací
1. POLE mutované endometriální nádory (skupina ultramutovaných endometriálních karcinomů)
Skupina ultramutovaných endometriálních karcinomů vykazující patogenní mutaci v genu POLE je nejdůležitější skupinou endometriálních nádorů, jejíž definice a diagnóza přináší pacientkám největší benefit. Pacientky v této skupině bývají mladší než v ostatních skupinách, vykazují vynikající prognózu, a to i přes jinak nepříznivé morfologicko-klinické rysy většiny těchto tumorů. Mezi 294 pacientkami s patologickou POLE mutací v největší meta-analytické studii, 32 % vykazovalo lymfovaskulární invazi, 36 % vykazovalo hlubokou myometriální invazi a 5 % mělo metastázy v lymfatických uzlinách. 51 % tumorů bylo grade 3. Přesto 98 % pacientek vykazovalo 5 leté přežívání bez progrese onemocnění. I když 29 pacientek v této meta-analytické studii mělo stadium nádorů III/IV, pouze 3 pacientky vykazovaly další progresi onemocnění, a to i přes radioterapii a chemoterapii (1), což ukazuje na fakt, že chemoterapie a radioterapie nemá v této skupině nádorů nejspíše žádný léčebný efekt (1).
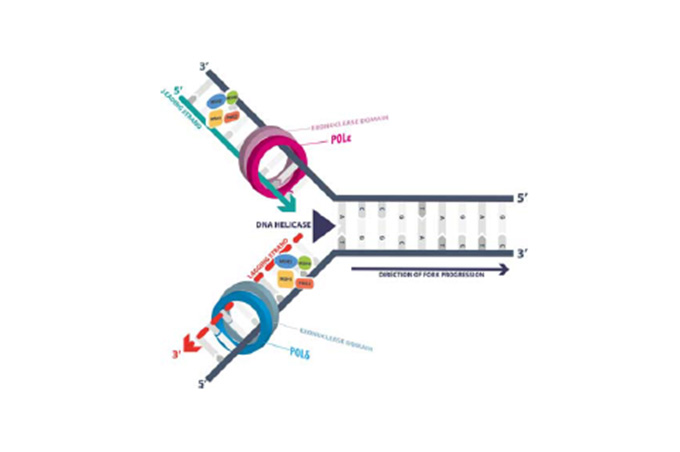
Gen POLE kóduje katalytickou podjednotku polymerázy ɛ a spolu s polymerázou δ jsou odpovědné za (téměř) bezchybnou DNA replikaci tím, že provádějí inkorporaci nukleových bází a jejich následnou kontrolu (proofreading) během DNA replikace (Obrázek 1.). Mutace tohoto genu v jeho exonukleázové doméně a z toho rezultující biologická nefunkčnost těchto polymeráz způsobuje obrovské množství somatických mutací v genomu endometriálních nádorů, a to více než 100 mutací (až 500 mutací) na 1 megabázi. Tyto karcinomy mívají vysoký histologický grade (grade 3), vykazují výraznou lymfoidní příměs, často vykazují lymfovaskulární a myometriální invazi, a přes tyto prognosticky negativní morfologické rysy mívají excelentní prognózu, a to i bez adjuvantní terapie. Vzácné recidivy nebo metastázy těchto nádorů pak velmi dobře reagují na imunoterapii checkpoint PD-1 inhibitory (nivolumab, pembrolizumab) a PD-L1 inhibitory (atezolizumab, avelumab, durvalumab).
POLE mutované nádory lze detekovat jednak klasickou Sangerovskou sekvenací, anebo modernější NGS sekvenací. Sangerovská sekvenace detekuje z důvodu nižší analytické senzitivity mutace genu POLE méně častěji než NGS sekvenace. Uvádí se, že je schopná zachytit pouze poloviční množství těchto pacientů. V závislosti na použité metodě je možné POLE mutace detekovat u 5 % (Sangerovská sekvenace) až 12 % (NGS sekvenace) pacientek s endometriálními karcinomy. Je zřejmé, že při použití zastaralé Sangerovské sekvenace zůstává více než 50 % POLE mutací nedetekováno a tyto pacientky pak bývají nesmyslně nadléčovány ozařováním a cytostatiky. V naší Bioptické laboratoři s.r.o. mutace v genu POLE detekujeme výhradně NGS sekvenací a to pomocí našeho NGS onkopanelu GynCore, který obsahuje 16 genů a který jsme si nechali cíleně sestavit pro tento typ nádorů u firmy ArcherDX (2). Tato nová metoda je zásadně preferována především proto, že u nádorů odhalí o 100 % více POLE mutací a je tudíž nejen o mnoho přesnější. Navíc, v jediném vyšetření nám dovoluje zjistit molekulární aberace i dalších významných genů, majících prognostický i léčebný vliv u nádorů endometria (CTNNB1, BRCA1/2, TP53, a jiné).
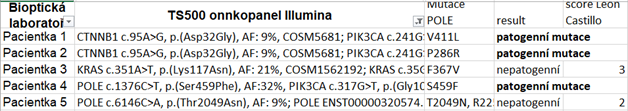
Velmi důležité je rozpoznat patogenní POLE mutace od nepatogenních POLE mutací. Nepatogenní POLE mutace nezpůsobují ultramutovaný fenotyp nádoru a na jeho prognózu nemají tudíž žádný vliv a proto nádory s nepatogenní mutací POLE genu do skupiny ultramutovaných tumorů nepatří. Jako patogenní se dnes uznávají následující mutace v 11 kodonech v exonukleázové doméně POLE genu: P286R, V411L, S297F, A456P, S459F, F367S, L424I, M295R, P436R, M444K, D368Y (3). Zcela nejčastější patogenní POLE mutace jsou P286R (50 %) a V411L (30 %) (4). Je zřejmé, že výčet patogenních POLE mutací se bude časem s pokračujícím výzkumem rozšiřovat, byly publikovány in-silico predikční nástroje pro zjišťování patogenicity nepopsaných mutací podle dalších biologických markerů jako je TMB a poměry záměn v DNA vzorku (3). Je zajímavé, že nepatogenní POLE mutace se většinou nachází ve skupině MMR deficientních nádorů (nádory patřící do hypermutované skupiny) a je tudíž pravděpodobné, že takovéto POLE mutace vznikají jako sekundární genetická událost, způsobená MMR deficiencí, bez vlivu na charakteristiku a biologické chování nádoru. Při posuzování prací starších několik let, které popisovaly metastatické chování u POLE mutovaných endometriálních nádorů je dnes zřejmé, že tyto práce vůbec nerozlišovaly mezi patogenními a nepatogenními mutacemi a považovaly za patogenní i ty POLE mutace, které byly v POLE genu lokalizovány i mimo jeho exonukleázovou doménu (všechny dnes uznané patogenní mutace POLE genu leží v jeho exonukleázové doméně) a tyto tumory by se dnes vůbec do ultramutované skupiny endometriálních karcinomů nezařazovaly. Je tedy zřejmé, že rozlišení patogenní a nepatogenní POLE mutace je extrémně důležité a ne zcela jednoduché. Při detekci neznámé POLE mutace u endometriálního karcinomu se u ní posuzuje jednak tzv. mutační nálož (tumor mutation burden – TMB) (u ultramutované skupiny musí být větší než 100 mutací na 1Mb) a dále se posuzuje prevalence C>A, T>G a C>G substitucí a poměr delecí a rekurence mutace v EC. Tyto parametry rozhodují o tom, zdali je POLE mutace patogenní či nikoliv (3). Tyto genetické parametry POLE mutací je možné podle návodu Leon-Castillové a spol. kvantifikovat pomocí skóre od 1-6. POLE mutace mající POLE skóre 1 a 2 jsou nepatogenní, POLE mutace mající POLE skóre 3 jsou mutace neznámého významu a patologické mutace mají POLE skóre dle Leon-Castillové a spol. 4-6 (3). Posouzení těchto parametrů se v naší laboratoři provádí následnou NGS sekvenací nádorů za použití panelu TruSight Oncology 500 od firmy Illumina obsahující 523 „cancer-relevantních genů“ (5) (Tabulka 1.). Netřeba zdůrazňovat, že bez NGS sekvenace nádorů posouzení, zda nalezená POLE mutace je nebo není patogenní, není možné. Sangerovská sekvenace toto neumožňuje.
Při posuzování výsledků imunohistochemického a molekulárně genetického vyšetření je třeba vědět, že u asi 3 % případů vychází pozitivně více určujících znaků užívaných pro zařazení do jedné ze čtyř skupin této klasifikace, a mluví se o přítomnosti tzv. „multiple classifiers“ (6). U těchto 3 % nádorů tak u jednoho karcinomu můžeme např. prokázat nejenom patogenní mutaci POLE genu, ale zároveň i MMR deficienci a p53 mutaci. Takovéto případy stále řadíme do 1. skupiny ultramutovaných nádorů a MMR deficienci a p53 mutaci považujeme za vedlejší nález bez klinického významu - MMR deficience a p53 mutace se v těchto případech považují za pouhé „genetické passengery“. U jiných případů může vyjít zároveň MMR deficience a p53 mutace bez průkazu POLE mutace. Tyto případy patří do 2. skupiny tzv. hypermutovaných karcinomů a p53 mutace se zase považuje za „genetického passengera“ bez klinického významu. Třetí možností je karcinom s patogenní POLE mutací a p53 mutací bez MMR deficience. Tyto případy spadají do 1. skupiny ultramutovaných nádorů a p53 mutace se opět považuje za „genetického passengera“. U posuzování karcinomů s touto „multiple classifiers“ charakteristikou je opět zásadní, aby laboratoř prováděla detekci POLE mutací technikou NGS a nikoliv pouze Sangerovskou sekvenací. Jak bylo zmíněno, Sangerovská sekvenace je málo citlivá metoda a není schopná zachytit až 50 % POLE mutací. U takovýchto případů s „multiple classifiers“, kde se z důvodu nižší citlivosti Sangerovské sekvenace nerozpozná přítomnost patogenní POLE mutace, zákonitě dochází k chybné klasifikaci nádoru z 1. skupiny hypermutovaných nádorů do 2. skupiny hypermutovaných nádorů nebo dokonce do 4. skupiny (tzv. copy number high endometriální karcinomy) s následným nesmyslným nadléčením cytostatiky a případně i ozářením (6).
Reference
- McAlpine JN et al. Evaluation of treatment effects in patients in patients with endometrial cancer and POLE mutations: An individual patient data meta-analysis. Cancer 2021:127:2049-2422.
- Democratizing precision oncology (archerdx.com)
- Alicia León-Castillo et al.: Interpretation of somatic POLE mutations in endometrial carcinoma. Journal of Pathology, 2020: 250:323–335.
- McAlpine et al.: Evaluation of treatment effects with endometrial cancer and POLE mutations: An individual patient data meta-analysis. Cancer, 2021, in press
- trusight-oncology-500-and-ht-data-sheet-1170-2018-010.pdf (illumina.com)
- Clinicopathological and molecular characterization of ‘multiple‐classifier’ endometrial carcinomas - León‐Castillo - 2020 - The Journal of Pathology - Wiley Online Library
2. Hypermutovaná (MMR deficientní) skupina karcinomů endometria
Tuto skupinu tvoří kolem 25-30 % nádorů endometria. Do této skupiny nádorů patří karcinomy endometria mající deficientní MMR systém (Mismatch repair). Na rozdíl od polymerázy δ a polymerázy ɛ během DNA replikace, které jsou kódované POLE a POLD1 geny, MMR systém je postreplikační mechanizmus, který identifikuje a opravuje chyby na úrovni nukleových bází a inzercí/delecí generovanými během DNA syntézy a rekombinace, čímž zabraňuje přenosu těchto chyb do dceřiných buněk. MMR proteiny, MLH1, PMS2, MSH2 and MSH6 identifikují tyto chyby, směřují je k excizi a korektní resyntéze. Protože celý tento MMR mechanizmus redukuje počet chyb spojených s replikací, genetické defekty v tomto systému výrazně zvyšují množství spontánních mutací a iniciují tumorigenezi. Protože mikrosatelity (krátké repetitivní úseky DNA) jsou obzvláště citlivé na vznik chyb, vzniká u těchto nádorů stav, který se nazývá mikrosatelitní nestabilita (MSI). MSI je tudíž produktem defektního MMR systému. I když mechanizmus vzniku mutací v této 2. hypermutované skupině je zcela odlišný od 1. ultramutované skupiny, výsledkem je též vysoká mutační nálož tumoru, i když nedosahuje tak vysokých hodnot jako je tomu u 1. ultramutované skupiny nádorů.
Hypermutovaná skupina karcinomů endometria zahrnuje MSI-H karcinomy (karcinomy s vysokou mikrosatelitní nestabilitou) s vysokým počtem mutací. Téměř výhradně se jedná o endometrioidní adenokarcinomy, všech grade stupňů, i když převažuje grade 3, nebo z nich vznikající karcinosarkomy, a dále světlobuněčné a nediferencované karcinomy. Serózní karcinomy se v této skupině téměř nevyskytují. Často je přítomna lymfovaskulární invaze. Jejich prognózu lze charakterizovat jako intermediární, závislou na stádiu onemocnění. Asi 10 % nádorů v této skupině mají pacienti s Lynchovým syndromem (viz též www.lynch.cz ), což znamená, že 3 % všech endometriálních karcinomů vzniká u pacientů s tímto syndromem. Zárodečná mutace genu MSH2 je nejčastější genetickou aberací u Lynchova syndromu u endometriálních karcinomů (asi 40 %), následuje zárodečná mutace v genu MLH1 (30 %) a MSH6 (30 %). Více než 90 % nádorů v této skupině jsou však sporadické nádory bez genetické rodinné zátěže. Sporadické nádory v této skupině vykazují somatické mutace v genech MLH1, MSH2, MSH6, PMS2, nebo hypermetylaci promotoru pro MLH1 gen. Tyto změny prokazujeme buďto geneticky pomocí PCR (93% citlivost metody), nebo NGS sekvenací (97% citlivost metody), anebo imunohistochemicky, neboť tyto nádory vykazují imunohistochemickou negativitu s protilátkami proti MMR proteinům (MLH1, MSH2, MSH6, PMS2) (94% citlivost metody) (1). Tyto metody si jsou navzájem komplementární, navzájem se doplňující. Pacientky s Lynchovým syndromem mají endometriální nádory v mladším věku (mladší než 50 let) než nádory sporadické. Nádory endometria většinou předchází u těchto pacientek nádorům kolorektálním. 20 % těchto pacientek s Lynchovým syndromem mají zároveň endometrioidní karcinom ovaria. Sporadické nádory endometria způsobené metylací promotoru pro MLH1 gen přicházejí u starších žen než ostatní sporadické nádory (starší než 65 let) a mají vyšší FIGO stadium a horší prognózu. Velice důležité je, že všechny nádory, jak sporadické, tak ty spojené s Lynchovým syndromem, v této skupině velmi dobře reagují na imunoterapii (2), kterou FDA schválil u MMR deficientních nádorů již v roce 2017 (3).
Reference
- Pan-Cancer Biomarkers: Changing the Landscape of Molecular Testing | Archives of Pathology & Laboratory Medicine (allenpress.com)
- Phase II Study of Avelumab in Patients With Mismatch Repair Deficient and Mismatch Repair Proficient Recurrent/Persistent Endometrial Cancer | Journal of Clinical Oncology (ascopubs.org)
- Mismatch repair in endometrioid endometrial cancer: Increasing our therapeutic proficiency by capitalizing on molecular deficiency (wiley.com)
3. Nádory s nespecifickým molekulárním profilem - no specific molecular profile (NSMP)
3. skupina zahrnuje největší množství nálezů – 40-60 % nádorů endometria. Patří sem endometriální karcinomy s nízkým počtem somatických početních alterací (copy number low) a nízkou mutační náloží. Jedná se výhradně o endometrioidní karcinomy, často s nízkým gradem, nesoucí estrogenní i progesteronové receptory. V této skupině ale mohou být i vysoce maligní nádory. Tyto tumory vykazují PTEN a PIK3CA mutace v 77 % a 53 % případů (1,2). Typická pacientka je starší žena s vysokým BMI. Její prognóza je tedy závislá na stádiu onemocnění, další charakteristice nádoru, a lze ji opět označit prognosticky jako intermediální až dobrou. Tato skupina je, co do genetické charakteristiky, nejvíce heterogenní, a je zřejmé, že se bude v budoucnosti nejspíš dále členit a bude dávat vznik dalším skupinám. Většina nádorů v této skupině vykazuje mutaci v CTNNB1 genu. Dále se v této skupině nádorů nacházejí genetické abnormality v PI3K signální cestě, především ztráta genu PTEN (77 %) a mutace PI3KCA (53 %), které jsou terapeuticky targetovatelné mTOR inhibitory, popřípadě CDK4/6 inhibitory (3). V malém procentu případů se v této skupině nádorů nacházejí KRAS mutace.
Reference
- Kandoth C et al. Integrated genomic characterization of endometrial carcinoma. Nature 2013:497:67-73.
- Gargiulo P et al. Tumor genotype and immature microenvironment in POLE-ultramutated and MSI-hypermutated endometrial cancers. Cancer Treat Rev 2016:48:61-68.
- Jamieson A et al. The emerging role of molecular pathology in directing the systemic treatment of endometrial cancer. Ther Adv Med Oncol 2021:13:1-14.
4. Karcinomy s mutací TP53
Tato 4. skupina, též nazývaná jako „copy number high“ představuje nejagresivnější podtyp endometriálních karcinomů. I když představuje jenom 15 % všech endometriálních karcinomů, je zodpovědná za 50-70 % úmrtí na tyto nádory. Je charakterizována velkým množstvím genetických numerických aberací, malým množstvím mutací, a obligátními mutacemi v TP53 genu. Zcela výjimečně tumory v této skupině vykazují PTEN a KRAS mutace. Do této skupiny též spadají karcinomy, vznikající u pacientů se somatickými a zárodečnými mutacemi v genech BRCA1/2, u kterých výskyt karcinomu vykazuje mírně zvýšené riziko. Většina těchto tumorů s BRCA1/2 mutacemi mívá většinou serózní morfologické charakteristiky (1). Dále do této skupiny spadá převážná většina HER2 pozitivních endometriálních karcinomů endometria (2).
Morfologicky do této skupiny spadá většina serózních karcinomů a karcinosarkomů. TP53 mutace se ale mohou nalézt i ve všech dalších histologických variantách a ve všech gradech endometriálních karcinomů včetně endometrioidních karcinomů endometria grade 1, a ve světlobuněčných karcinomech endometria. Nebyly nalezeny žádné statisticky významné odlišnosti mezi jednotlivými histologickými podtypy, a serózní karcinomy měly stejně špatnou prognózu jako ostatní neserózní typy endometriálních karcinomů v této skupině nádorů (3). Na rozdíl od ostatních skupin, pacienti jedině v této skupině vykazovali významný benefit léčbou chemoterapií i radioterapií (3). Dále serózní karcinomy v této skupině, které vykazovaly amplifikaci HER2/neu (24 % až 30 % nádorů v této skupině) (4,5) a vykazovaly významný benefit při léčení trastuzumabem (a petruzumabem) v kombinaci s chemoterapií (6).
Reference
- De Jonge MM et al. Endometrial cancer risk in women with germline BRCA or BRCA2 mutations: multicenter cohort study. JNCI J Natl Cancer Inst 2021, in press
- Vermij L et al. HER2 status in high risk endometrial cancers (PORTEC-3): Relationship with histotype, molecular classification, and clinical outcome. Cancers 2021, in press
- Leon-Castillo A. et al.: Molecular classification of the PORTEC-3 trial for high-risk endometrial cancer: Impact on prognosis and benefit from adjuvant therapy. J Clin Oncol 2020:38:3388-3397.
- Vermij L et al. Performance of a HER2 testing algoritm specific for p53-abnormal endometrial cancer. Histopathology, 2021, in press
- Buza N et al. Reproducibility of scoring criteria for HER2 immunohistochemistry in endometrial serous carcinoma: a multi-institutional interobserver agreement study. Mod Pathol 2021:34:1194-1202.
- Fader AN et al.: Randomized phase II trial of carboplatin-paclitaxel versus carboplatin-paclitaxel-trastuzumab in uterine serous carcinomas that overexpress Human Epidermal Growth Factor Receptor 2/neu. J Clin Oncol 2018:36:2044-2051.
Likvidní biopsie • NGS (Next Generation Sequencing)
Možnost monitorování recidiv pomocí detekce bezbuněčné DNA z periferní krve (tzv. likvidní biopsie) metodou masivního paralelního sekvenování
V naší Bioptické laboratoři s.r.o. mutace v genu POLE detekujeme výhradně NGS sekvenací, a to pomocí našeho NGS onkopanelu GynCore. Mimo gen POLE, panel GynCore obsahuje dohromady 16 genů, které jsou relevantní v diagnostice endometriálních karcinomů. Tato nová metoda je zásadně preferována především proto, že u nádorů odhalí dvojnásobek POLE mutací než Sangerovská sekvenace a je tudíž o mnoho přesnější, ale také umožňuje monitorování recidiv detekcí bezbuněčné DNA z periferní krve. Vzhledem k tomu, že tento onkopanel obsahuje 16 různých genů, je téměř pravidlem, že v každém nádoru nalezneme mutaci minimálně v jednom, nebo spíše ve více těchto genech najednou. Identické mutace lze zastihnout v periferní krvi při recidivě nádorů, jelikož endometriální nádory tuto volnou bezbuněčnou DNA vyplavují poměrně velmi časně. Záchyt volné DNA v periferní krvi často předchází až 6 měsíců nálezu metastáz diagnostikovaných pomocí jiných klasických zobrazovacích metod (např. PET). Díky této metodě bude tudíž možné daleko dříve změnit neúspěšný léčebný postup, a navíc při použití imunoterapie u 2. skupiny (Hypermutovaná MMR deficientní skupina endometriálních nádorů) bude možné monitorovat, zdali tato finančně velmi nákladná léčba je od svého začátku účinná (imunoterapie u MMR deficientních nádorů je úspěšná „pouze“ u přibližně 50 % pacientů). Při včasném odhalení neúčinnosti této léčby imunoterapií tak dojde k velké úspoře finančních prostředků.
Customizovaný NGS onkopanel na detekci volné DNA budeme mít k dispozici v Bioptické laboratoři s.r.o. od konce roku 2021.